前言[了解一下背景,知道我吹的啥]
[我研究的東(dong) 西對人生活有用]
有機疊氮化合物是許多藥物分子、含能材料和化學探針的重要組成部分。它們(men) 還是合成天然產(chan) 物、藥物分子和農(nong) 用化學品的重要砌塊。
[我研究的東(dong) 西在科研上有用]
另外疊氮化物廣泛應用於(yu) 經典有機方法學中,如Staudinger還原和連接反應、Huisgen環加成、點擊反應、Schmidt反應以及aza-Wittig反應。最近,疊氮化合物在過渡金屬催化C-H胺化反應中被用作氮賓前體(ti) 。尤其是在多步合成中,R-N3可當作受保護的胺。
[讓開,我要吹牛皮了]
這裏,我們(men) 報道第一例鐵和光介導的、未活化烯烴的反馬氏氫疊氮化反應。
[大家看看牛皮在哪]
該轉化使用NaN3作為(wei) 性質穩定的疊氮源,反應對空氣和濕度不敏感,並且可以在溫和條件下進行,這也使得該反應有很好的官能團兼容性。
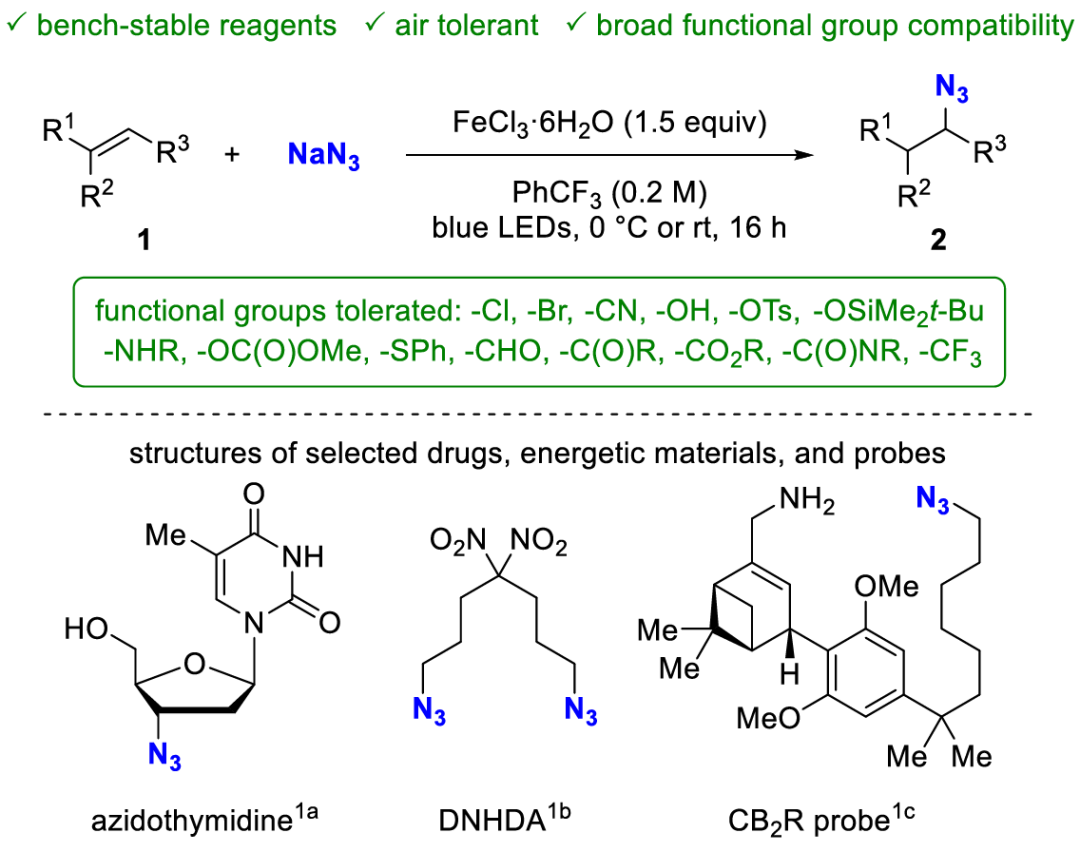
[有機方法學創新很重要,我研究的東(dong) 西有意義(yi) ]
有機疊氮化合物在合成化學與(yu) 生物學中廣泛應用,這使得通過易獲得原料直接生成該類化合物的方法學創新非常有必要。
[以前大家用的啥方法]
傳(chuan) 統方法學中,有機疊氮化合物通過親(qin) 核取代以及重氮和疊氮轉移反應合成。作為(wei) 補充方法,直接利用烯烴轉化為(wei) 烷基疊氮也已得到了研究。早期Hassner和Kropp的研究集中在將HN3加成到烯烴上,從(cong) 而可得到相應的馬氏加成產(chan) 物。
[我們(men) 在這個(ge) 領域還是很牛皮的,順便引一下自己組的論文]
我們(men) 利用鈷催化劑、矽烷和TsN3的組合,已經開發了一種更溫和、適應性更好的條件來實現非活化烯烴馬氏氫疊氮化的方法。
[別人的工作]
隨後Boger揭示馬氏氫疊氮化可能是通過鐵氫(Fe-H)中間體(ti) 進行。
[反馬氏選擇性的工作]
為(wei) 得到反馬氏加成產(chan) 物,往往需要進行多步反應。直到最近,對於(yu) 雙鍵直接的反馬氏疊氮化才被報道。Chiba和Gagosz研究了一種高價(jia) 碘試劑(azidobenziodoxolone,ABX)用於(yu) 高烯丙基苯醚的氫疊氮化,後者在反應中作為(wei) 分子內(nei) 氫原子給體(ti) 。
於(yu) 煒及其同事報道了利用Ir光催化劑和TMSN3實現不飽和芳基酰胺氫疊氮化反應。最近Xu和劉國生課題組分別從(cong) TMSN3和benziodoxolone中原位生成高價(jia) 碘試劑ABX以實現反馬氏氫疊氮化。
[前人的工作不行,還是我們(men) 牛皮]
盡管取得了這些重要進展,但仍缺乏使用NaN3作為(wei) 現成且廉價(jia) 的疊氮源的簡便方法。
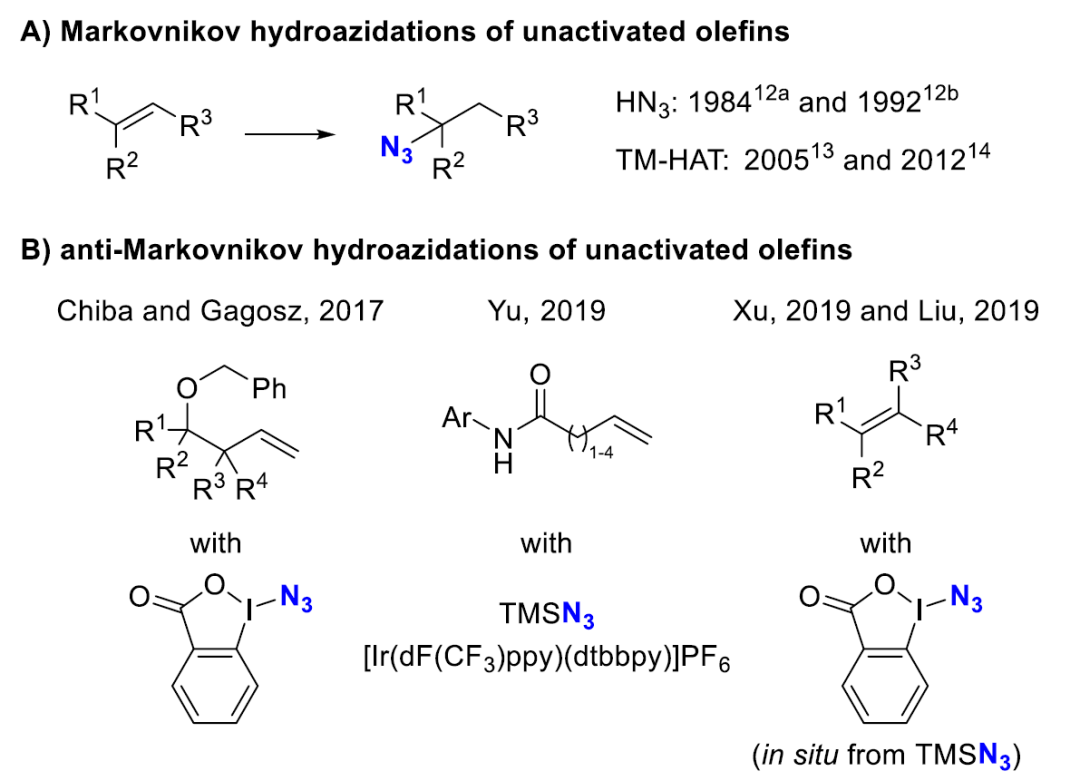
[寫(xie) 論文就是一個(ge) 吹牛皮的過程,懂的都懂。這個(ge) 過程主要集中在引言部分,以上內(nei) 容采用原文中的視角(斜體(ti) 加粗是解讀,其它為(wei) 原文對應翻譯)。但以下內(nei) 容由於(yu) 相對客觀,故用第三人稱解讀。]
/二/條件優(you) 化
可見光激發過渡金屬(如CuII, TiIV和FeIII)鹽能引發配體(ti) 到金屬電荷轉移(ligand-to-metal charge transfer, LMCT)過程,可實現二氯化、二疊氮化或Giese 反應。基於(yu) 此認知以及作為(wei) 最豐(feng) 富過渡金屬的鐵,其配合物能在藍光照射下產(chan) 生自由基,作者設想或許鐵鹽可用於(yu) 烯烴的氫疊氮化反應中,並以溫和具有選擇性的方式進行。
作者篩選了不同的條件參數包括鐵鹽,溶劑(注意!安全隱患:疊氮可以取代二氯甲烷中的氯,而生成極易爆炸的中間體(ti) ,所以在使用疊氮時一定盡量避免使用二氯甲烷作為(wei) 溶劑)以及光源等。
他們(men) 發現當使用FeCl3 • 6H2O作為(wei) 金屬鹽,PhCF3為(wei) 反應溶劑,在0 °C條件下藍光照射16小時,目標分子產(chan) 率可達83%。需要指出的是,當該反應使用無水FeCl3時,僅(jin) 得到痕量的產(chan) 率。
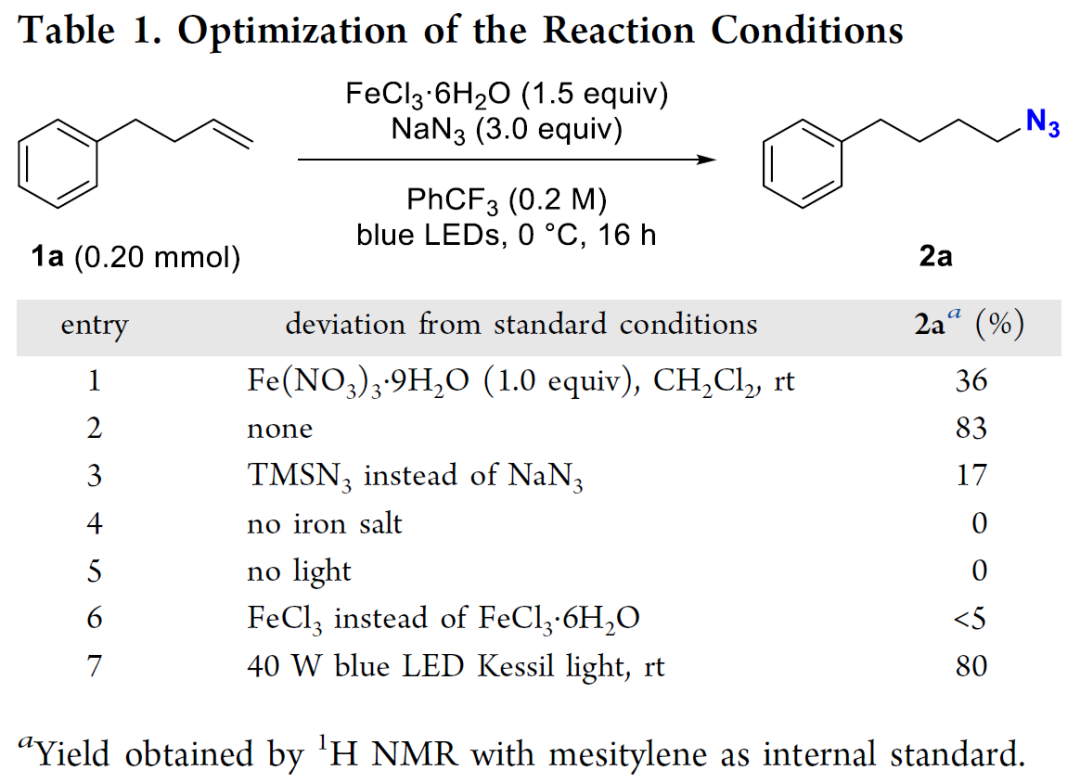
/三/底物拓展
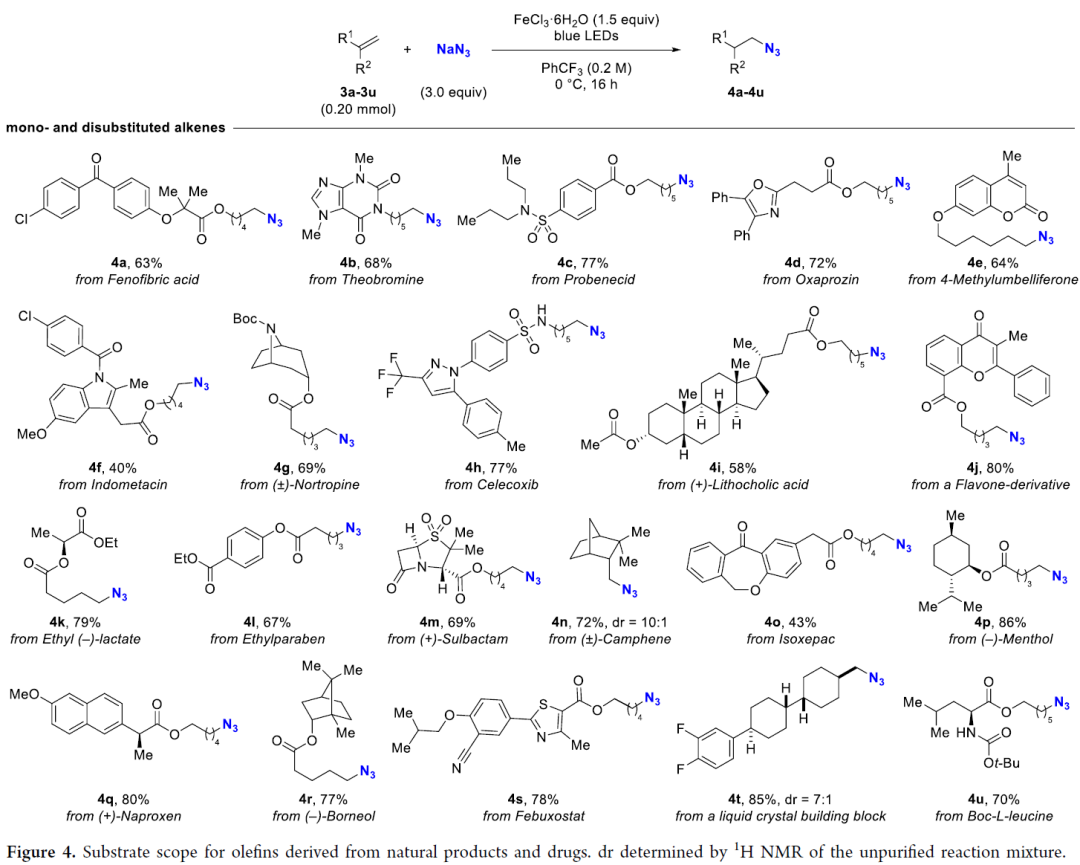
在得到最優(you) 條件後,作者對底物範圍進行了考察。結果表明含有不同官能團的單、二、三、四取代烯烴都能順利生成目標疊氮化合物,如鹵素、氰基、羥基、氨基、三氟甲基等基團均可兼容該反應。
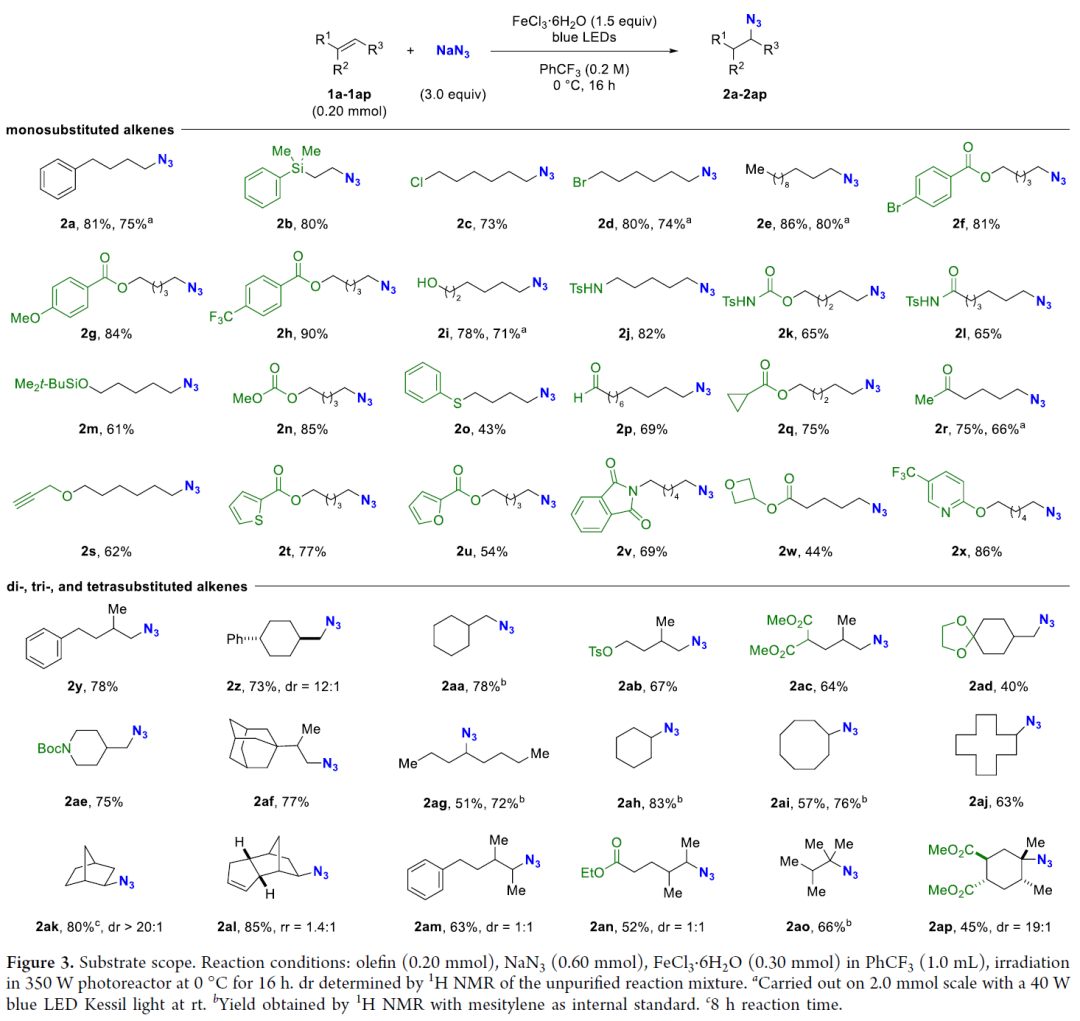
/四/應用
該反應還可以應用到後期官能團化中,許多藥物活性分子和天然產(chan) 物表現出了很好的兼容性。
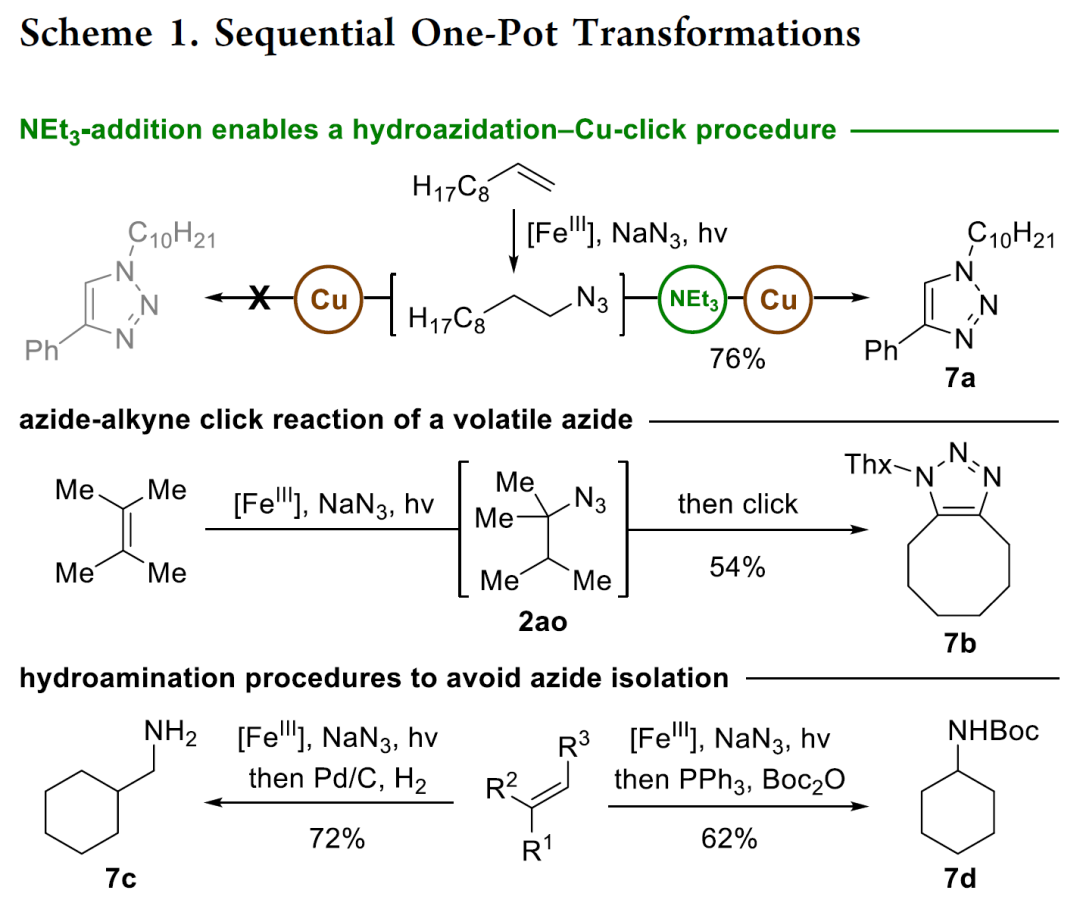
此外,為(wei) 了避免後處理、溶劑蒸發、純化、分離和疊氮中間體(ti) 的處理,作者還進行了一鍋法合成。如使用“一鍋兩(liang) 步”實現了點擊反應和氫胺化反應。
/五/機理研究
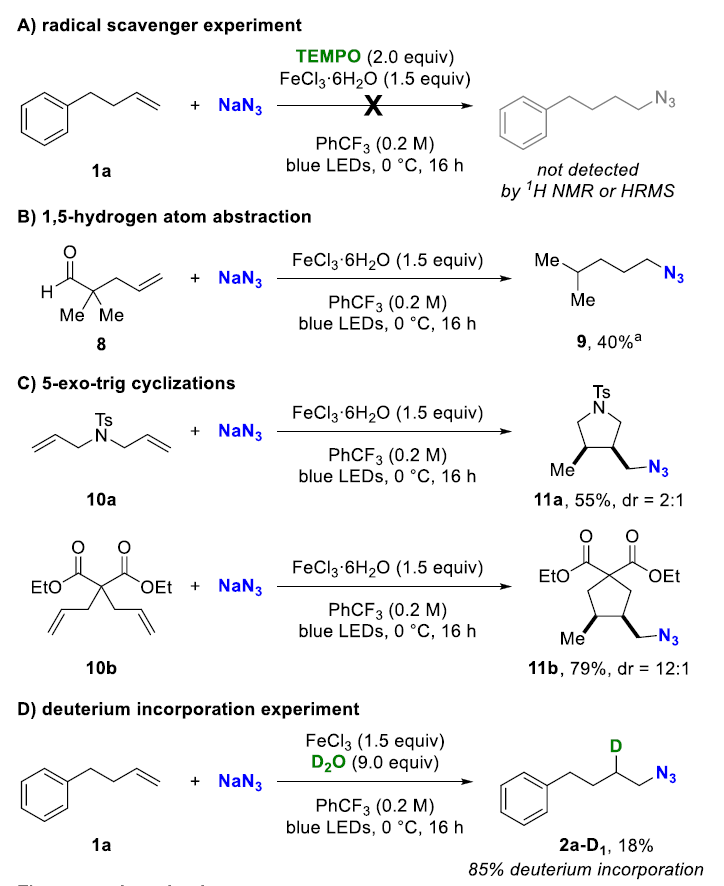
為(wei) 了深入探究該反應機理,作者還進行了以下實驗。
A. 自由基捕捉實驗:未檢測到目標產(chan) 物,說明該反應過程涉及自由基中間體(ti) 。
B. 醛的1,5-氫原子攫取反應:得到脫羰基產(chan) 物,說明烯烴生成了二級碳自由基,隨後從(cong) 醛中通過1,5-氫自由基攫取獲得氫原子,並經曆脫碳基生成更穩定的三級自由基,而後被淬滅。
C. 5-exo-trig環化反應:僅(jin) 得到環化產(chan) 物,表明淬滅要慢於(yu) 環化過程。
D. 氘代實驗: 在其它條件不變下,鐵鹽替換為(wei) 無水FeCl3,並以水為(wei) 添加劑。當使用H2O時可以得到77%的產(chan) 率,但當用D2O僅(jin) 得到18%的產(chan) 率。該結果表明,水是終端氫源,並且二級碳自由基最後的氫原子轉移過程很可能是決(jue) 速步。
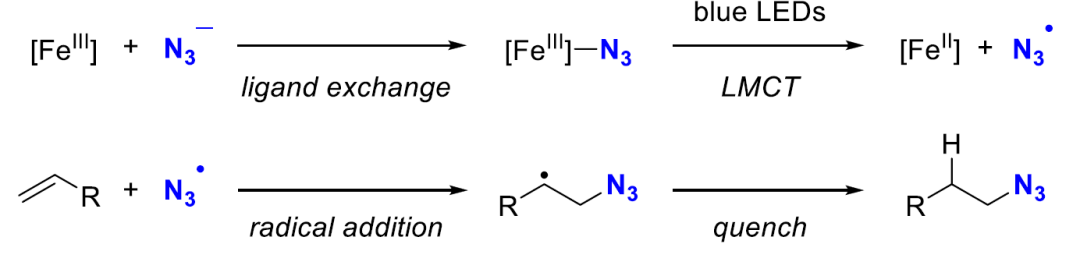
提出的機理
基於(yu) 前人的工作以及以上探究實驗,作者提出以下機理。即三價(jia) 鐵與(yu) 疊氮陰離子通過配體(ti) 交換給出Fe-N3物種,其在藍光照射下通過LMCT過程產(chan) 生二價(jia) 鐵以及疊氮自由基。隨後烯烴與(yu) 該自由基進行自由基加成得到二級烷基自由基,再經過淬滅(氫原子轉移)生成最終產(chan) 物。
/六/總結
瑞士蘇黎世聯邦理工學院(ETH Zürich)、JACS主編Erick M. Carreira課題組發展了FeCl3 • 6H2O和光介導的、非活化烯烴的反馬氏氫疊氮化反應。該反應利用廉價(jia) 易得且性質穩定的NaN3作為(wei) 疊氮源,對空氣和濕度不敏感,並有著廣泛的底物適用性和官能團兼容性。該反應還能應用到許多複雜分子的後期修飾中,為(wei) 合成各種有機疊氮化合物提供了簡單而實用的新方法。
/七/評論
評論者:
@讀者C:該工作利用廉價(jia) 易得且性質穩定的NaN3作為(wei) 氮源,實現了一係列含不同官能團烯烴以及複雜分子的疊氮化,為(wei) 疊氮化合物的合成提供了一種實用和高效的新方法。
@讀者H:就這!要放在我們(men) 課題組,壓根就發不了JACS。
@讀者E:在我看來,這更像是技術創新而非科學。
@讀者M:看來有機方法學發文章更重視應用了,是不是基礎創新逐漸乏力了呀。
原文鏈接:https://pubs.acs.org/doi/10.1021/jacs.3c09122













評論已經被關(guan) 閉。