作為(wei) 留學申請中具有相當含金量的化學科目,AS階段是積累大塊分值的關(guan) 鍵時期,紮實清晰的知識脈絡是穩步 A*的重中之重。其中在化學 U2的學習(xi) 中,運算邏輯的繁瑣和眾(zhong) 多焓變定義(yi) 的紮堆是部分考生的一大難點,本篇將由理綜教研部老師結合高頻出現的焓變運算技巧與(yu) 易錯點,為(wei) 大家分享攻克這一重要章節的方法和策略。
焓變專(zhuan) 題
攻分精講
『量熱實驗』
此部分對應課本 6C、6D兩(liang) 小節內(nei) 容,分別考察燃燒焓與(yu) 中和焓的實驗測算,分別對應教材 154麵與(yu) 156麵。
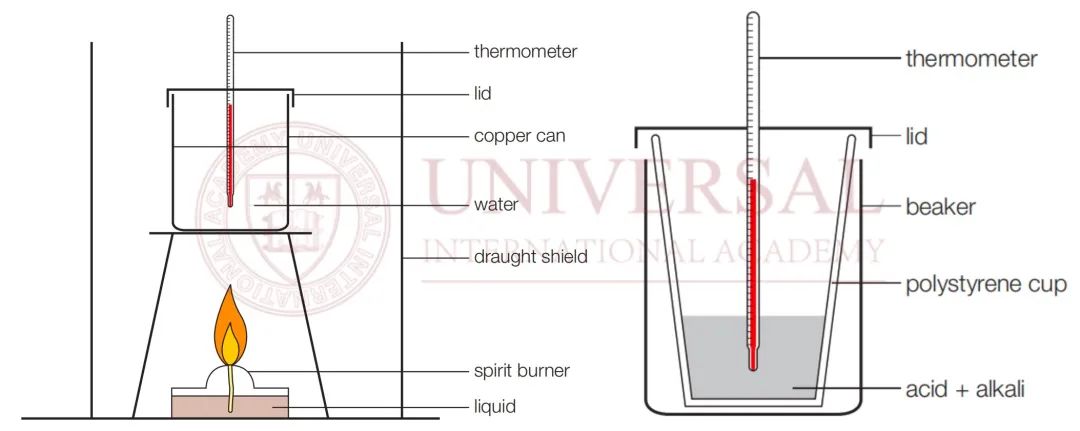
來源:燃燒焓實驗測算(左),中和焓實驗測算(右)
不管考察哪一種,計算思路都是三步走:
第一步,計算熱量:Q=mcΔT( )
)
第二步,計算摩爾數n
第三步,計算焓變: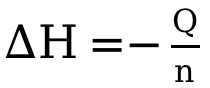
在燃燒焓的測算實驗中,實驗邏輯是以燃燒釋放的熱量使水升溫,以水的溫度變化來估算燃燒過程中產(chan) 生的熱量,因此在用 Q=mcΔT計算熱量時,注意 m、c、ΔT指向的對象均為(wei) 水,分別指水的質量、水的比熱容,以及水的溫度變化。其中,質量 m可通過 m=ρV來進行計算 (水的密度為(wei)  )。
)。
而在中和焓的測算實驗中,實驗邏輯是以酸堿中和反應釋放的熱量使溶液升溫,以溶液的溫度變化來估算中和過程中釋放的熱量。此處的溶液為(wei) 酸、堿混合溶液,因此在用 Q=mcΔT計算熱量時,m、c、ΔT指向的對象則為(wei) 酸堿混合溶液。出於(yu) 計算方便,可將其近似為(wei) 水,密度 ρ、比熱容 c均取水的數值即可,如: 。
。
第二步摩爾數的計算,可結合焓變概念來確認計算對應物質的摩爾數。在燃燒焓的測算中,指的是 Spirit Burner中燃燒物質的摩爾數,一般用公式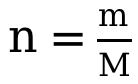 來進行計算;在中和焓的測算中,指的是生成的液態水的摩爾數,
來進行計算;在中和焓的測算中,指的是生成的液態水的摩爾數,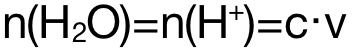 。
。
在第三步的計算中,需要特別注意,公式前的負號不要遺漏。部分考生運算結果的數值是正確的,但正負號弄反了,就是因為(wei) 遺漏了該公式中的負號;也有部分考生是因為(wei) 第一步中 ΔT顛倒了正負號,千萬(wan) 注意 ,後減前,並不是單純大的數值減去小的數值。
,後減前,並不是單純大的數值減去小的數值。

來源:模擬作答中考生運算結果負號遺漏
*延伸知識點:量熱實驗中的誤差分析
1、燃燒焓的誤差原因分析:
(1)heat loss to surroundings
(2)incomplete combustion of alcohol
(3)evaporation of alcohol
2、中和焓的誤差原因分析:
(1)heat loss to surroundings (最主要原因)
(2)measuring uncertainties due to the use of pipette and thermometer
(3)not stirred evenly
(4)heat capacity of the solution is not exactly 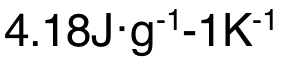
『赫斯定律』

來源:教材 158麵赫斯定義(yi) 定義(yi) 詞條
根據赫斯定律,能量變化隻與(yu) 初末狀態有關(guan) ,與(yu) 反應路徑無關(guan) 。換言之,若反應可分步進行,則總反應的焓變與(yu) 各分步反應焓變的總和相等。
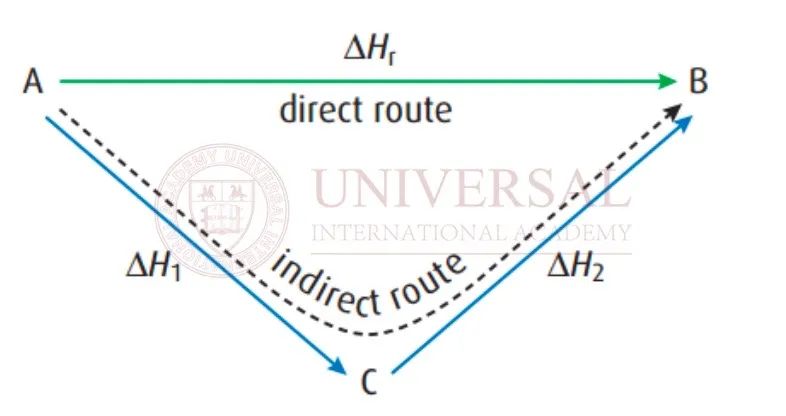
來源:理綜教研部內(nei) 部整合焓變講義(yi) 截圖
以上圖為(wei) 例,由 A到 B,綠色箭頭表示直接路徑,藍色箭頭表示間接路徑,兩(liang) 條路徑的焓變值一致,滿足: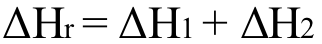 。對於(yu) 一些反應進程較慢、不易發生、無法直接測量焓變的反應,可通過赫斯定律來間接計算得出。
。對於(yu) 一些反應進程較慢、不易發生、無法直接測量焓變的反應,可通過赫斯定律來間接計算得出。
舉(ju) 例說明:
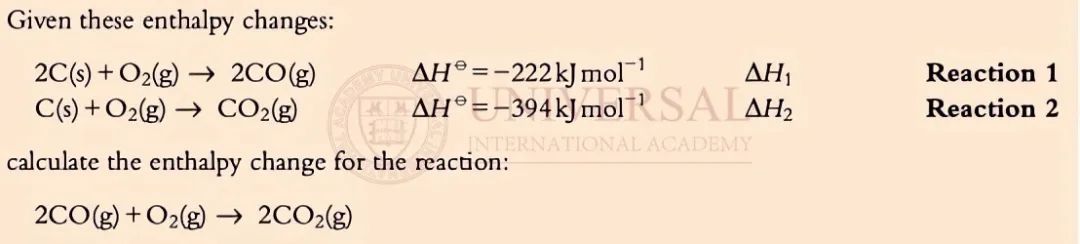
來源:理綜教研部內(nei) 部整合焓變講義(yi) 截圖
理綜教研部強調在建立赫斯三角時,需將待求的目標方程寫(xie) 在上方,觀察給定的已知焓變方程,與(yu) 待求焓變的目標方程建立聯係。
在 Reaction 1中,方程右側(ce) 出現的 CO,在待求目標方程的左側(ce) 也出現了,因此,如下圖黃色高亮部分顯示,可把 Reaction 1建入 Hess's Cycle,箭頭由 Reaction 1的反應物指向生成物。把上方方程中未參與(yu) Reaction 1反應的 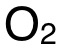 照抄到下方,如圖橙色高亮部分所示。
照抄到下方,如圖橙色高亮部分所示。
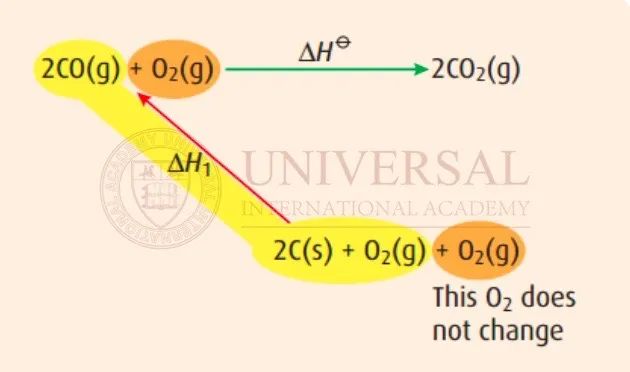 來源:理綜教研部內(nei) 部整合焓變講義(yi) 截圖
來源:理綜教研部內(nei) 部整合焓變講義(yi) 截圖
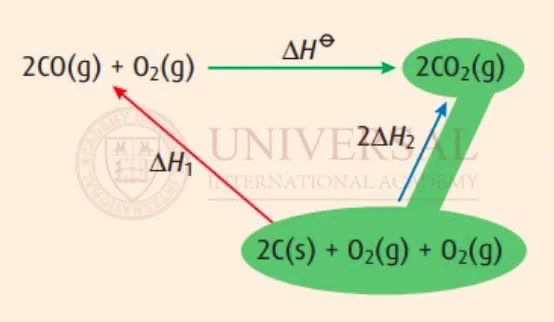
在 Reaction 2中,反應物 C(g)、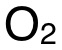 (g)在下方,生成物
(g)在下方,生成物  (g)在上方,因此箭頭方向由下到上,如圖藍色箭頭所示。綠色高亮區域即表示 Reaction 2的焓變。
(g)在上方,因此箭頭方向由下到上,如圖藍色箭頭所示。綠色高亮區域即表示 Reaction 2的焓變。
此處需特別注意,Reaction 2中的反應物、生成物係數均為(wei) 1,而 Hess's Cycle中,是由 2mol的 C(g)、與(yu) 1mol的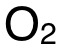 (g)生成 2mol的
(g)生成 2mol的 (g),反應物、生成物前的係數均為(wei) 2,所以
(g),反應物、生成物前的係數均為(wei) 2,所以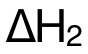 的值需乘以 2,才是右側(ce) 藍色箭頭所示焓變值。
的值需乘以 2,才是右側(ce) 藍色箭頭所示焓變值。
 來源:理綜教研部內(nei) 部整合焓變講義(yi) 截圖
來源:理綜教研部內(nei) 部整合焓變講義(yi) 截圖
至此,Hess's Cycle已建立,可將藍色箭頭表示的反應路徑視為(wei) DirectRoute,紅色箭頭與(yu) 綠色箭頭表示的反應路徑視為(wei) Indirect Route,就有:
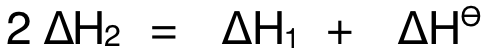
把  、
、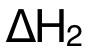 的對應數據代入,即可求得
的對應數據代入,即可求得 
在利用赫斯定律進行焓變運算時,理綜教研部溫馨提示:箭頭的方向需按焓變定義(yi) 由反應物指向生成物,並注意運算時是否需要乘以係數,避免不必要的計算錯誤。
*延伸知識點:由赫斯定律,還可延伸得到兩(liang) 個(ge) 計算焓變的公式:
1)根據燃燒焓計算生成焓: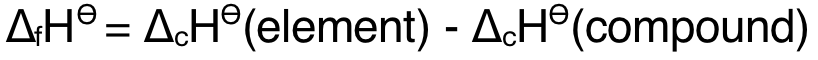
2)根據生成焓計算反應焓:
在滿足條件時,直接應用公式來進行計算,更方便快捷。
『鍵能運算』
以鍵能計算反應焓,需牢記運算公式:

此類計算題難度不大,但書(shu) 寫(xie) 中有幾處細節需注意:
1)過程要分步
2)係數別漏乘
3)區分單雙鍵
以 2021年 10月真題卷中的題目為(wei) 例進行具體(ti) 說明:
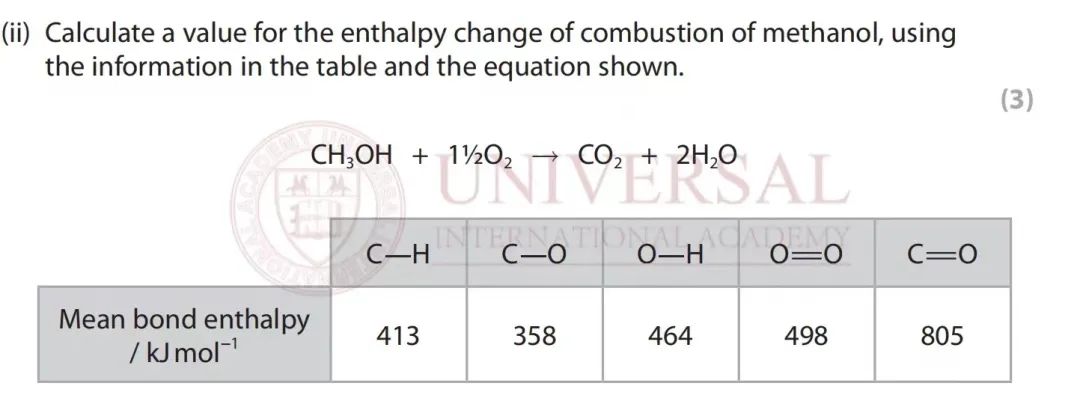
來源:2021年 10月化學 U2真題
首先計算Σ(bondbroken),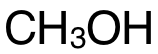 含有 3個(ge) C-Hbond、1個(ge) C-Obond和 1個(ge) O-Hbond,
含有 3個(ge) C-Hbond、1個(ge) C-Obond和 1個(ge) O-Hbond,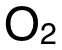 含有一個(ge) O=Obond,因此:
含有一個(ge) O=Obond,因此:
Σ(bondbroken)= 3×E(C-H) + E(C-O) + E(O-H) + 1.5×E(O=O)
= 3×413+358+464+1.5×498
= +2808 
同理可計算出:
Σ(bondmade)= 2×E(C=O) + 4×E(O-H) = 2×805+4×464 = 3466
最後再代入公式即可:
 = 2808 - 3466 = -658
= 2808 - 3466 = -658
在前兩(liang) 步中,可把所有物質的 Displayed Formula畫出來,更清晰地確認各化學鍵的數量。需注意的是,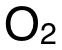 內(nei) 部的化學鍵為(wei) O=O雙鍵,
內(nei) 部的化學鍵為(wei) O=O雙鍵, 包含兩(liang) 個(ge) C=O雙鍵,若題目中給了單鍵的鍵能,千萬(wan) 不可落入陷阱。在第二步 Σ(bondmade)的計算過程中,部分考生錯把 E(C-O)的數值代入進行計算,就是因為(wei) 沒有區分單鍵和雙鍵。
包含兩(liang) 個(ge) C=O雙鍵,若題目中給了單鍵的鍵能,千萬(wan) 不可落入陷阱。在第二步 Σ(bondmade)的計算過程中,部分考生錯把 E(C-O)的數值代入進行計算,就是因為(wei) 沒有區分單鍵和雙鍵。
另外,係數的漏乘也是主要錯因之一。一方麵要考慮方程式中化學式前的係數,另一方麵,還需考慮一個(ge) 分子內(nei) 部是否包含多於(yu) 1個(ge) 的同種化學鍵。此題中,化學式裏 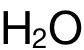 前麵的係數為(wei) 2,可理解為(wei) 產(chan) 生 2個(ge) 水分子;而每個(ge) 水分子又含有 2個(ge) O-Hbond,因此 E(O-H)前需乘係數 4。
前麵的係數為(wei) 2,可理解為(wei) 產(chan) 生 2個(ge) 水分子;而每個(ge) 水分子又含有 2個(ge) O-Hbond,因此 E(O-H)前需乘係數 4。
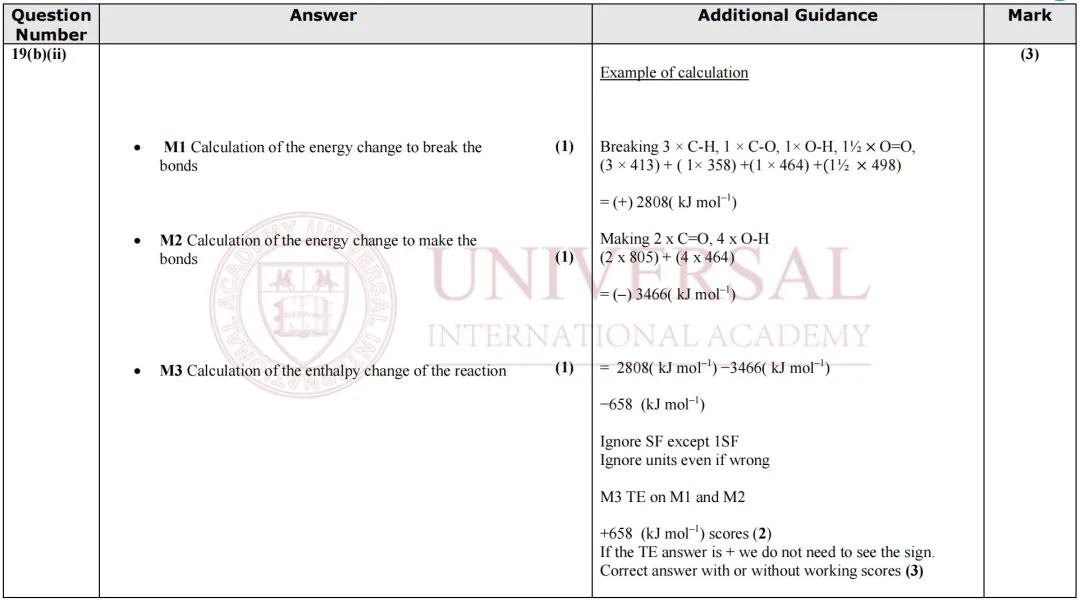
來源:2021年 10月化學 U2真題MarkScheme
參考閱卷標準,Σ(bondbroken)、Σ(bondmade)的分別計算各有 1分,兩(liang) 者相減算出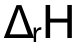 ,再得 1分。各位考生一定注意分步書(shu) 寫(xie) ,這樣即使最後一步結果出錯,也能得到前麵的 2分步驟分。
,再得 1分。各位考生一定注意分步書(shu) 寫(xie) ,這樣即使最後一步結果出錯,也能得到前麵的 2分步驟分。
*延伸知識點:用鍵能計算反應焓變,計算結果有誤差的原因:
一方麵,由鍵能的定義(yi) ,可知鍵能是針對氣體(ti) 狀態下的化學鍵而言的,若反應中物質不是氣態,直接用鍵能計算就忽略了物質狀態之間的能量差。

圖源:教材 160麵鍵能定義(yi) 詞條
另一方麵,需考慮到 Mean Bond Enthalpy和 Specific Bond Enthalpy之間的差異。為(wei) 方便計算,題目中提供的都是平均鍵能,此數值與(yu) 特定分子中的某個(ge) 特定鍵能相比,存在偏差。
因此,用鍵能計算得出的反應焓數值與(yu) Databook Value有偏差的原因,可表述為(wei) 以下兩(liang) 點:
1)Bondenthalpiesarebasedonsubstancesinthegaseousstate,butinthereaction,…isaliquid/solid
2)Bondenthalpiesareaveragedforthebondindifferentchemicalenvironment, not the actual bond enthalpies in the reaction.
以上就是理綜教研部針對化學 U2中大分值考點焓變專(zhuan) 題易錯點的整合解析,涵蓋踩分點與(yu) 標準表述,還需反複閱讀熟悉內(nei) 化,助力各位在接下來的賽季中能夠穩步前進,預定 A*!















評論已經被關(guan) 閉。