作為(wei) 賽季中第一批次的考核科目,化學 U1的複習(xi) 進度總需要適當提前,尤其是真題與(yu) 易錯點的集訓。所包含的五個(ge) 章節分為(wei) 無機和有機兩(liang) 大板塊,Topic 1-3屬於(yu) 無機化學,其中第一章節的計量專(zhuan) 題就穩定在 33%上下的分值,足以見得其重要性。本篇將由理綜教研部 Charon何老師就前三章無機板塊的易錯題型作簡要梳理,助力各位把握攻分策略,成功摘星。
考點整合
真題解析
『Topic 1-Avogadro Constant』
阿伏加德羅常數 Avogadro Constant 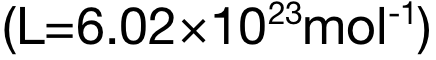
在真題中的考察形式主要為(wei) 兩(liang) 種:
1. 已知物質質量 (mass)或摩爾數 (moles),求給定粒子 (atom/molecule/ion/electron)的數量;
2. 已知粒子總數,求物質質量。其中前者考察頻次較高,一般出現在 Section A選擇題型中,分值為(wei) 1分/題;有時或出現在 Setion B簡答題中,要求考生列出解答步驟,分值為(wei) 2-4分/題。
對於(yu) 這類題型,包括集訓與(yu) 平時作業(ye) 中,錯誤原因往往都是:僅(jin) 通過質量計算出物質的摩爾數後,就選擇了答案,而忽視了題幹中給定的粒子類型。

來源:理綜教研部內(nei) 部集訓冊(ce)
以此題為(wei) 例,要求計算 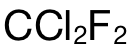 分子 (molecule)中的原子數量 (the number of atoms)。完整的做法為(wei) :第一步使用公式 n=m/M,計算出
分子 (molecule)中的原子數量 (the number of atoms)。完整的做法為(wei) :第一步使用公式 n=m/M,計算出 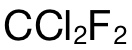 的摩爾數,即:2.42g÷121 g/mol=0.02mol;第二步,則是計算 atom的摩爾數,在 1mol的
的摩爾數,即:2.42g÷121 g/mol=0.02mol;第二步,則是計算 atom的摩爾數,在 1mol的 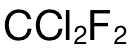 中總共有 5mol的 atoms,所以 0.02mol中應該有 0.02×5=0.1mol的atoms;最後再乘上阿伏加德羅常數 L,可得 atom的數量為(wei) 0.1×
中總共有 5mol的 atoms,所以 0.02mol中應該有 0.02×5=0.1mol的atoms;最後再乘上阿伏加德羅常數 L,可得 atom的數量為(wei) 0.1×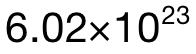 =
=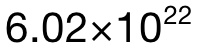 。
。
而考生錯選 D的原因就是直接使用 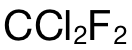 的摩爾數乘上阿伏加德羅常數,並沒有考慮到每個(ge)
的摩爾數乘上阿伏加德羅常數,並沒有考慮到每個(ge) 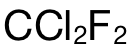 分子中的 atoms的數量為(wei) 5。
分子中的 atoms的數量為(wei) 5。
『Topic 2-Electronic Configuration』
電子排布 Electronic Configuration部分知識要求考生理解電子構型的基本方式並能以 s,p,d,f或方框形式表示原子與(yu) 離子的電子排布,多在 Setion A中考察,分值為(wei) 1-2分/題。
理綜教研部根據考生集訓記錄,歸納以下兩(liang) 大易錯點:
1. 當電子數超過 18,排布時需先排 4s再排 3d。
2. 兩(liang) 大原則需清晰理解:洪特規則 Hund’s rule——the electrons will occupy the orbitals singly before pairing takes place,即先占軌道再配對;泡利不相容原則 Pauli Exclusion Principle——two electrons cannot occupy the same orbital unless they have opposite spins,即在同一軌道中的兩(liang) 個(ge) 電子自旋方向相反。
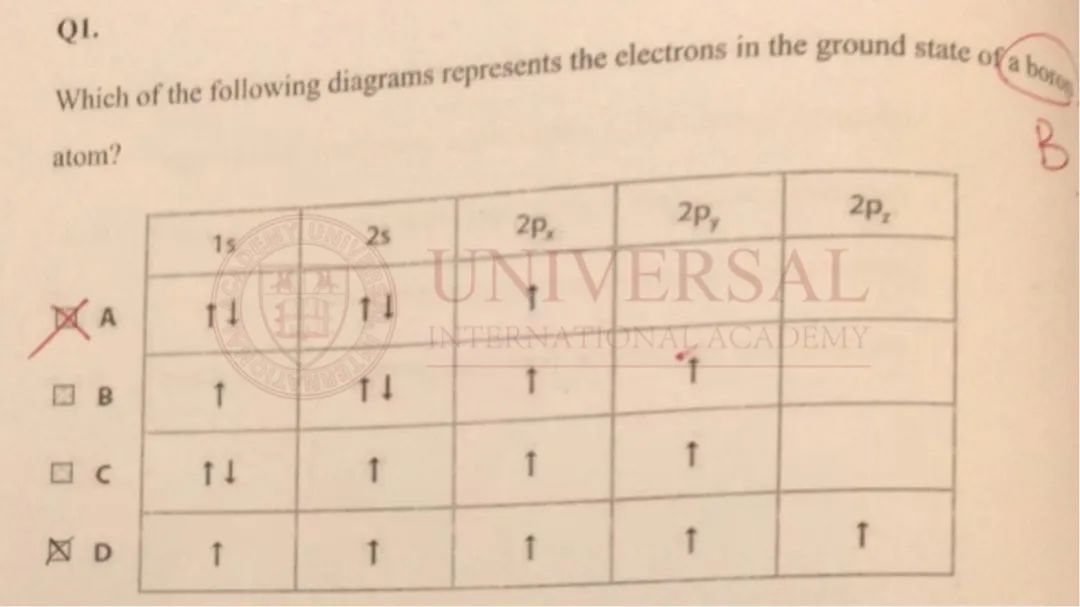
來源:理綜教研部內(nei) 部集訓冊(ce)
在以上例題中,考生錯誤原因是誤以為(wei) 所謂的先占軌道再配對是先把所有的軌道占了再配對,但其實洪特規則目前主要適用於(yu) 軌道數不止一個(ge) 的 p sub-shell和 d sub-shell。因此,Boron的電子排布應先把 1s與(yu) 2s排滿,再繼續排列 2p,答案應選 A。
『Topic 2-Ionisation Energy』
相較而言,電離能知識點是抽象的,在初學時部分考生往往無法迅速理解。在真題中的 Setion A和 Setion B均會(hui) 出現,每題的分值為(wei) 1-8分不等。
其中有一種高頻出現的考察形式是給出某一特定元素的逐級電離能數值,來判斷其量子層中的電子數量與(yu) 所在主族數 (Group)。該題型的判斷依據即找到 Big Jump,所謂的 Big Jump就是指兩(liang) 個(ge) 相鄰電離能之間存在較大的差異。同時,逐級電離能中的 Big Jump就表示量子層的變化,即 Big Jump前後的兩(liang) 個(ge) 電子應該分屬於(yu) 兩(liang) 個(ge) 不同的量子層。

來源:理綜教研部內(nei) 部集訓冊(ce)
在以上內(nei) 部集訓選題中,可得出在元素 X的前五項電離能數值中,第三和第四電離能間存在 Big Jump,這意味著前三個(ge) 電子應該處於(yu) 同一量子層,而第四個(ge) 電子則已屬內(nei) 層。且電子是由外向內(nei) 電離的,因此最外層包含三個(ge) 電子,則該元素應屬於(yu) Group III。
『Topic 3—Polarisation of Ions』
離子的極化現象 Polarisation一般在 Setion A部分考察,Section B的表述題中也有出現,分值 1-2分/題。要求考生掌握影響極化的因素以判斷陽離子極化力的強弱和陰離子被極化的難易程度。需要熟記的是:對於(yu) 陽離子 (Cation)來說,電荷數越多,離子半徑越小,極化力越強;而對於(yu) 陰離子 (Anion)而言,電荷數越大,離子半徑越大,越容易被極化。
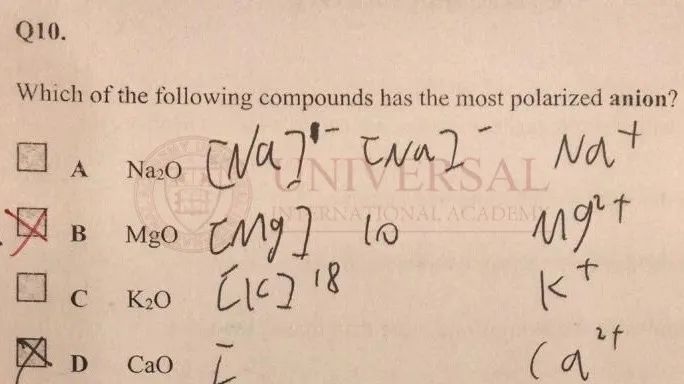
來源:理綜教研部內(nei) 部集訓冊(ce)
在以上例題中,問哪一個(ge) 陰離子 (Anion)更容易被極化。而此處陰離子均為(wei) 氧離子 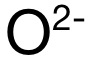 ,因此隻需確定極化力最強的陽離子 (Cation),也就是要需要電荷大,半徑小的陽離子。首先看電荷數:A和 C選項中的陽離子
,因此隻需確定極化力最強的陽離子 (Cation),也就是要需要電荷大,半徑小的陽離子。首先看電荷數:A和 C選項中的陽離子  和
和 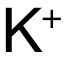 ,電荷數為(wei) 1,B和 D選項中
,電荷數為(wei) 1,B和 D選項中 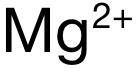 和
和 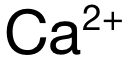 ,電荷數為(wei) 2,排除 A和 C。再看半徑:可得 Mg與(yu) Ca分別位於(yu) Period 3和 Period 4,電子層數上 Mg更少,因此
,電荷數為(wei) 2,排除 A和 C。再看半徑:可得 Mg與(yu) Ca分別位於(yu) Period 3和 Period 4,電子層數上 Mg更少,因此 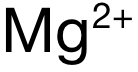 的半徑小於(yu)
的半徑小於(yu) 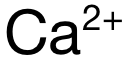 ,因此
,因此 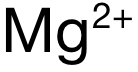 的極化力強於(yu)
的極化力強於(yu) 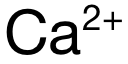 ,本題應選 B。
,本題應選 B。
以上為(wei) 理綜教研部針對化學 U1無機模塊中的易錯題分享,還需仔細閱讀,吸收內(nei) 化,預祝十月賽季各位都能夠 A*連連,取得理想的成績!













評論已經被關(guan) 閉。