文獻分享
Toehold Switch
De-Novo-Designed Regulators of Gene Expression
Alexander.A Green et al., Cell, 2014
合成生物學領域的研究人員們(men) 正麵臨(lin) 著設計和構建新型生物元件的巨大挑戰。傳(chuan) 統的基因調控器件往往受限於(yu) 動態範圍低、串擾高等問題,這極大限製了複雜基因網絡的構建。針對這一難題,哈佛大學等機構的科學家們(men) 創新性地設計了一種名為(wei) Toehold開關(guan) 的新型RNA調控器。
與(yu) 傳(chuan) 統調控器不同,Toehold開關(guan) 通過與(yu) 特定觸發RNA的線性-線性交互來激活基因表達,展現出超高的動態範圍和極低的串擾。這一突破性設計為(wei) 合成生物學提供了強大的新工具,有望在分子生物學和生物技術領域帶來廣泛應用。
1、第一代Toehold Switch及其功能驗證
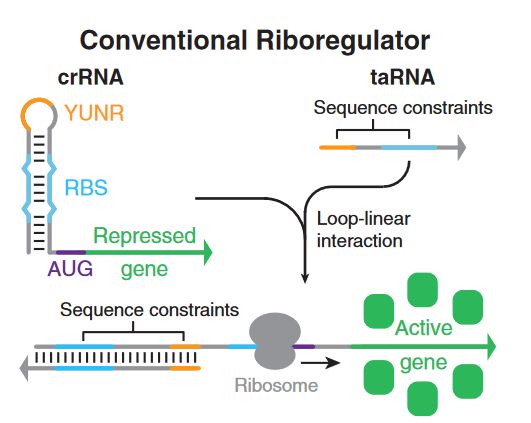
Figure 1. 傳(chuan) 統核糖體(ti) 調節器
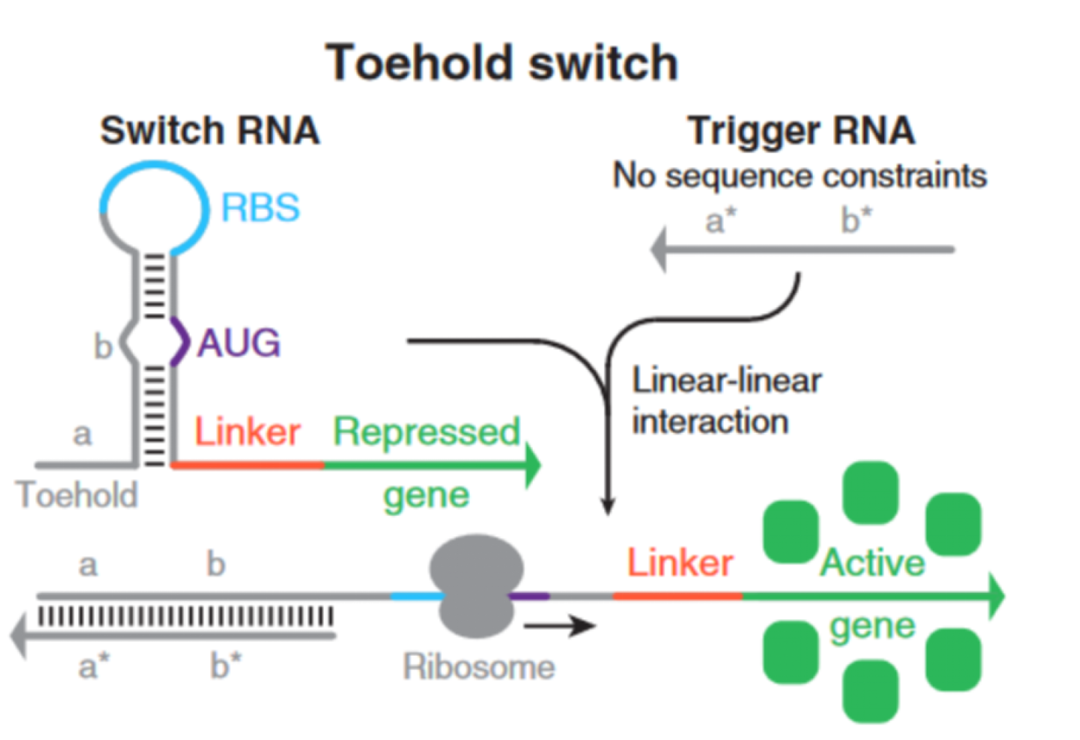
Figure 2. Toehold Switch
相對於(yu) 之前的RNA開關(guan) ,第一代“腳趾開關(guan) ”做了如下改變:
第一代“腳趾開關(guan) ”通過在起始密碼子(AUG)前後編程的堿基對抑製翻譯,使RBS和起始密碼子區域完全不配對。且在“發卡”結構前加入了一段“腳趾”序列a,“發卡”結構後通過Linker將“腳趾開關(guan) ”與(yu) 目的RNA序列連接起來。
當觸發RNA裏的序列a*和“腳趾”序列a互補配對時,“發卡”結構被打開,RBS序列及起始密碼子AUG暴露出來使RNA得以翻譯。
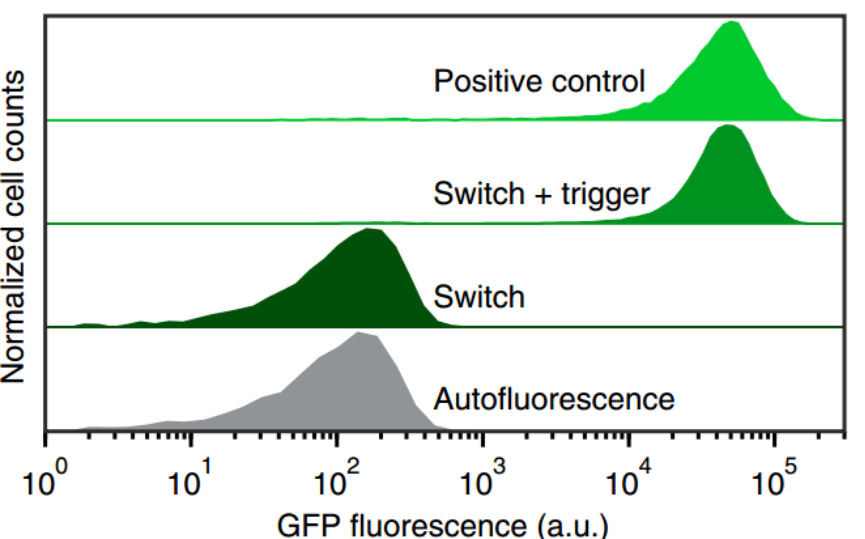
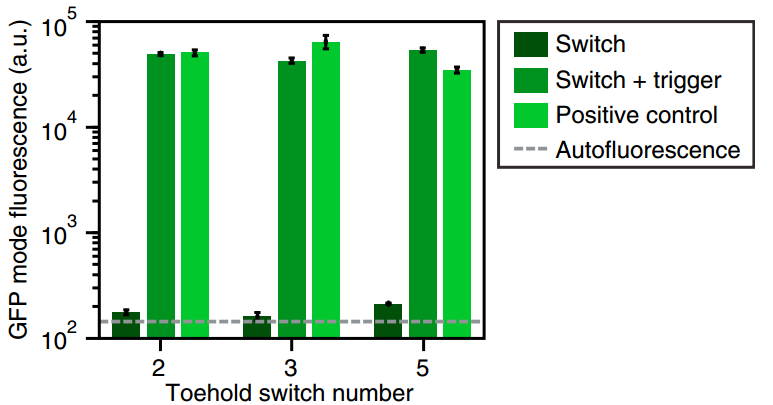
Figure 3-4. 表達強度驗證
Figure 3是與(yu) 大腸杆菌自身熒光和陽性對照相比,支點開關(guan) 的流式細胞術GFP熒光直方圖。Autofluorescence組為(wei) 不含GFP表達質粒的誘導細胞的自身熒光水平;Figure 4是與(yu) 陽性對照結構和自身熒光相比,開關(guan) 在ON和OFF狀態下測量的GFP模式熒光水平。
結果顯示,當“腳趾”開關(guan) 在加入觸發RNA時大腸杆菌表達的熒光強度與(yu) 陽性對照組相近,而“腳趾”開關(guan) 在不加入觸發RNA時大腸杆菌表達的熒光強度與(yu) 大腸杆菌自身熒光水平相近,說明第一代“腳趾”開關(guan) 有一定的調控能力。同時發現在“腳趾”開關(guan) 在不加入觸發RNA時存在少量熒光蛋白泄露表達現象。
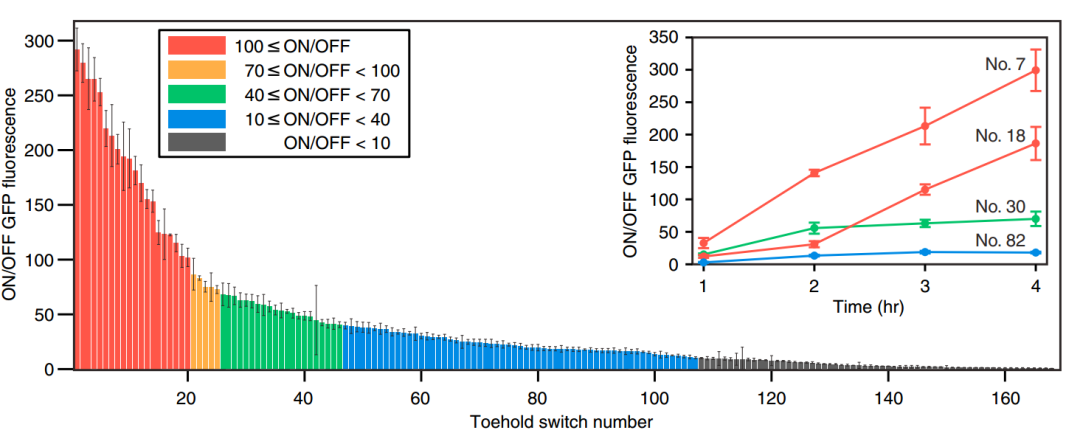
Figure 5. 第一代Toehold Switch On/Off
由圖知1至20的腳趾開光的工作性能較好,ON/OFF在100以上,而也存在部分開關(guan) 工作性能較低,ON/OFF在10以下。同時部分開關(guan) 的工作性能與(yu) 時間有關(guan) ,時間過程測量顯示,係統在誘導1小時內(nei) 激活,並且隨著GFP的持續產(chan) 生,開/關(guan) 比率隨著時間的推移而增加。
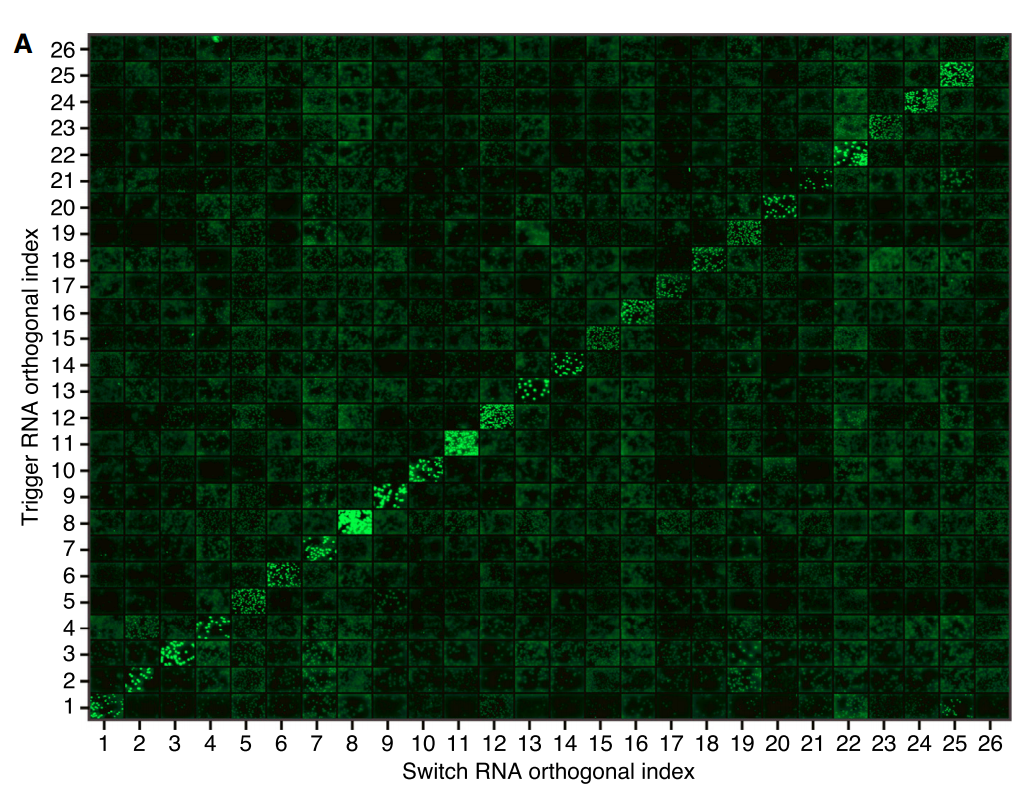
Figure 6. 第一代Toehold Switch正交性驗證
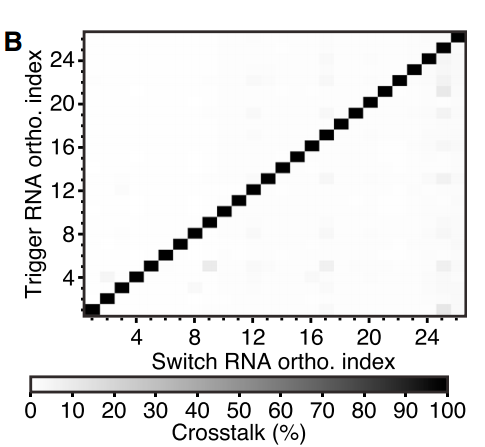
Figure 7.第一代Toehold Switch正交性驗證
Figure 6可見同源開關(guan) 和觸發RNA對沿網格對角線的強熒光效果,編號26處的最終開關(guan) 由於(yu) 其低開/關(guan) 比而顯示較低的熒光。低熒光水平觀察到非對角線元件具有非同源的觸發/開關(guan) RNA對。實驗說明第一代“腳趾”開關(guan) 有較強的正交性。
Figure 7通過將非同源觸發器和給定開關(guan) RNA獲得的GFP熒光除以開關(guan) 在觸發狀態下的熒光來計算串擾。測試的全套26個(ge) 開關(guan) 顯示的串擾小於(yu) 12%,說明了腳趾開關(guan) 的正交性較強。
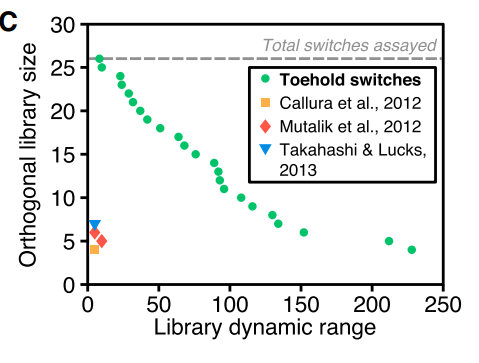
Figure 8. 第一代Toehold Switch庫正交性與(yu) 其它核糖體(ti) 調節器的對比
Figure 8為(wei) 該庫動態範圍指標與(yu) “腳趾”開關(guan) 的最大正交子集大小的關(guan) 係,以及同許多以前的RNA開關(guan) 的比較。(評估正交庫性能的一個(ge) 相關(guan) 指標是閾值串擾水平的倒數)說明了“腳趾”開關(guan) 相對於(yu) 之前的RNA開關(guan) ,它的正交性較強,抗幹擾能力較強,調控更加準確。
2、改進後的第二代開關(guan) 及其有效性驗證
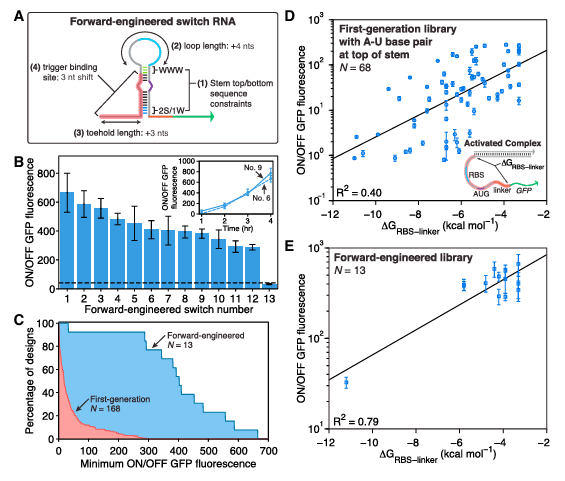
Figure 9. 改進後的第二代開關(guan) 及其有效性驗證
為(wei) 應對mRNA的複雜二級結構對基因調控的挑戰,科學家們(men) 對趾環開關(guan) 進行了多項改進:他們(men) 延長了mRNA感應型趾環的腳趾結構域至24個(ge) 核苷酸,以更好地穿透mRNA結構;融入了高效開關(guan) 的通用序列元件來增強激活效率;設計了RNA重折疊機製降低激活能障;並利用計算工具輔助設計和篩選,確保傳(chuan) 感器對目標RNA的高效識別。這些改進措施顯著增強了趾環開關(guan) 的性能和應用潛力。
通過一係列實驗驗證了這些改進措施的有效性:以mCherry mRNA為(wei) 例,定製的趾環開關(guan) 僅(jin) 在其存在下激活GFP表達,證明了開關(guan) 的特異性和響應性;類似地,趾環開關(guan) 還能有效識別編碼抗生素耐藥性的mRNA;以及內(nei) 源性sRNA RyhB的傳(chuan) 感器設計,通過外加誘導劑調控RyhB表達,成功地在細胞中監測了GFP輸出,進一步驗證了趾環開關(guan) 在複雜生理條件下的準確調控能力及其實用價(jia) 值。
3、內(nei) 源基因的探測及內(nei) 源表達
Toehold 開關(guan) 接受具有任意序列的 Trigger RNA的能力,理論上能夠被激活。但與(yu) 新設計的單鏈結構的Trigger RNA不同,mRNA中大量存在二級結構,使結合變得複雜,且同源Trigger mRNA也可能內(nei) 部配對或與(yu) 發夾模塊下遊的序列配對,可能阻礙開關(guan) 的激活。
對開關(guan) 檢測mCherry mRNA進行實驗驗證。開關(guan) 僅(jin) 在與(yu) mCherry mRNA結合時激活GFP表達,在無mCherry mRNA時低GFP表達。
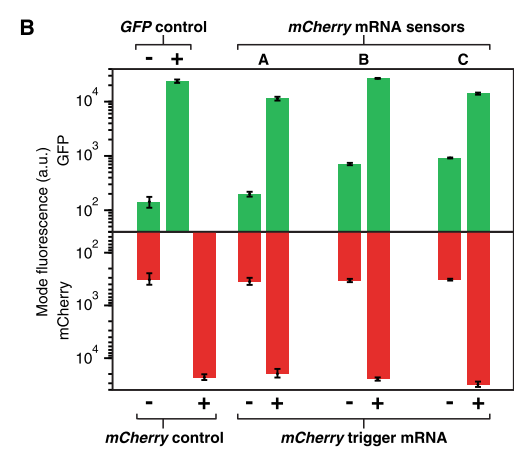
Figure 10. 驗證mCherry Toehold Switch表達GFP的正交性
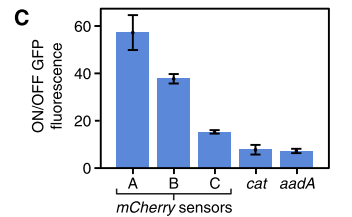
Figure 11. 三種mCherry mRNA響應開關(guan) 兩(liang) 種用於(yu) 檢測抗生素耐藥性的mRNA開關(guan) :cat和aadA的GFP的ON/OFF值
驗證了在同源Trigger mRNA缺失或存在的情況下,三個(ge) mCherry mRNA響應開關(guan) 的GFP和mCherry熒光水平。陰性對照為(wei) 大腸杆菌自身熒光,而陽性對照分別來自未抑製表達的GFP和mCherry的細胞。
結果表明,僅(jin) 在mCherry mRNA存在時才強烈激活GFP的表達,在沒有mCherry mRNA時低GFP表達。因此腳趾開關(guan) 可以檢測mCherry基因表達。並且由mRNA作為(wei) Trigger RNA時,腳趾開關(guan) 依然有較高的ON/OFF值。
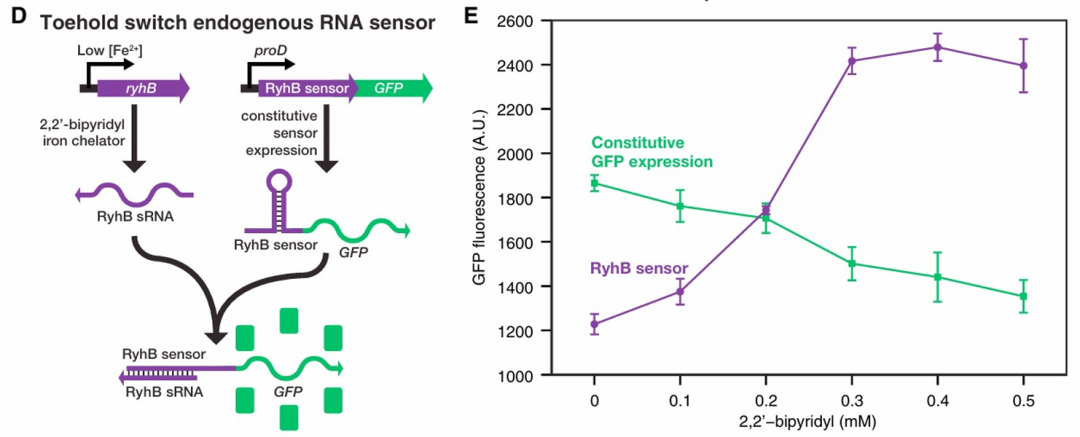
Figure 12. Toehold Switch探測內(nei) 源小RNA
對開關(guan) 檢測內(nei) 源小RNA RyhB進行實驗驗證。RyhB在Fe水平低時會(hui) 下調鐵相關(guan) 基因。用載有ryhb響應性調節GFP的腳趾開關(guan) 的質粒轉化細胞。
鐵螯合化合物2,20-聯吡啶可以快速刺激RyhB的表達,在培養(yang) 基中添加該化合物誘導RyhB sRNA表達。誘導後1小時流式細胞術量化表達。可見GFP陽性對照在2,20-聯吡啶濃度增加時表達減少,但加入了腳趾開關(guan) 的細胞隨著2,20-聯吡啶濃度增加,表達穩步增加,之後趨於(yu) 平穩。因此腳趾開關(guan) 可以檢測內(nei) 源RyhB基因表達。
4、Toehold Switch多重調節及4-input 與(yu) 邏輯回路
為(wei) 了表現Toehold Switch全部的多重控製能力,作者在同一個(ge) 細胞中表達了12個(ge) Toehold Switch,並用流式細胞術分別確認了這幾個(ge) 控製的活性。具體(ti) 基因線路設計如下圖:
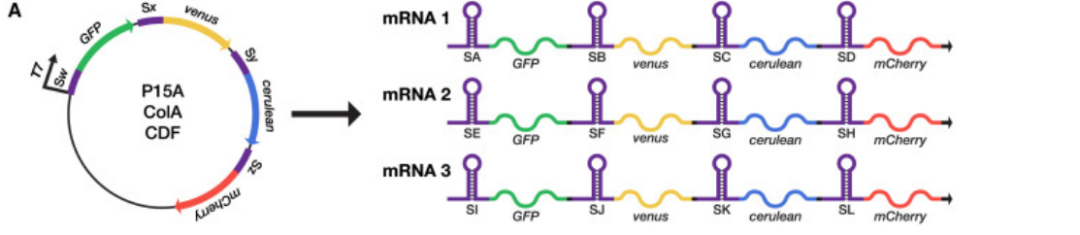
Figure 13. 12個(ge) Toehold Switch的基因線路設計
(補充:GFP,venus,cerulean,mCherry為(wei) 四種不同的熒光蛋白,以報告基因表達。SA-SL為(wei) 不同的二代文庫中的switch。以上mRNA大小約為(wei) 3.4kb,T7為(wei) 啟動子,質粒總大小約10kb)
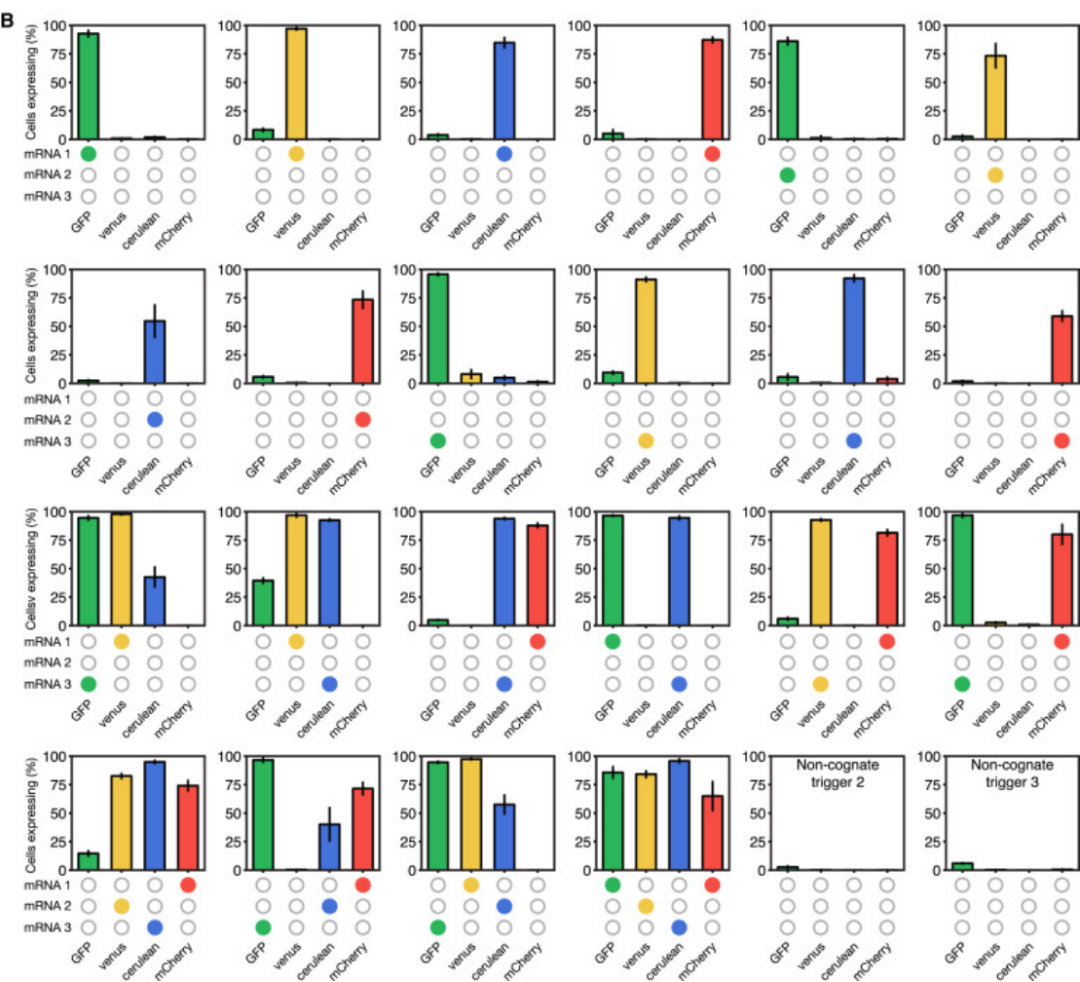
Figure 14. 多重調節實驗結果
實驗結果表明,二代Toehold Switch的正交性較好。在同時激活GFP/venus和venus/cerulean時出現明顯的泄露表達,作者將 “泄露”視為(wei) GFP、venus、cerulean三個(ge) 熒光蛋白光譜存在重疊導致的流式細胞術計數據的不完美補償(chang) 。實驗發現非同源Trigger也可以啟動泄露表達。
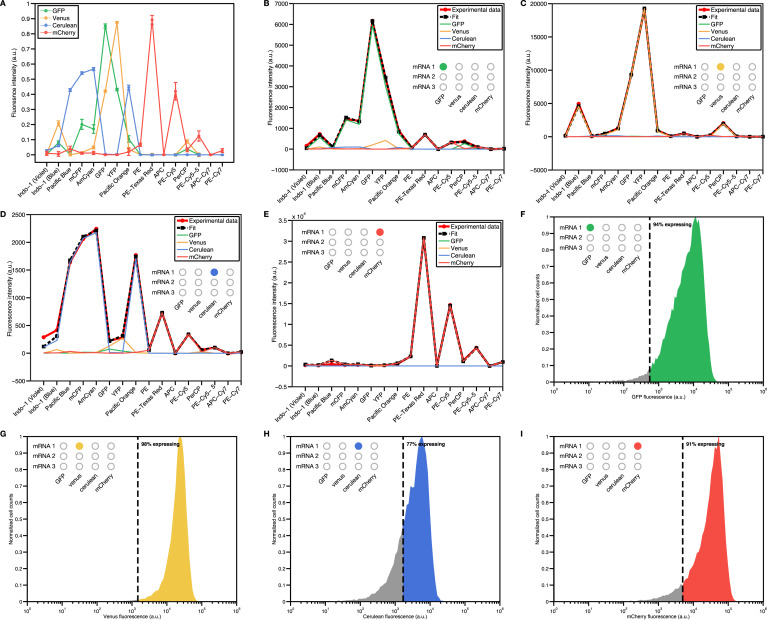
Figure 15. 單個(ge) 熒光蛋白在不同細胞中的表達情況數據來補償(chang) 流式細胞術得到的實驗數據後得到的結果(A為(wei) 四種蛋白在不同細胞中的表達情況,B-E為(wei) 分別為(wei) GFP、venus、cerulean、mCherry各自的不同細胞中表達情況表。F-I為(wei) 補償(chang) 後的流式細胞術數據結果)
作者用三對Trigger和Switch以及兩(liang) 種高度正交的ECF sigma因子構建四輸入的AND電路,用以驗證使用Toehold構建複雜回路的可行性。
具體(ti) 來說,他們(men) 用四種輸入啟動兩(liang) 組Trigger和Switch的表達,以表達出兩(liang) 種sigma因子,兩(liang) 種sigma因子再啟動下遊的另外一組Trigger和Switch以表達目標蛋白GFP。如下圖:
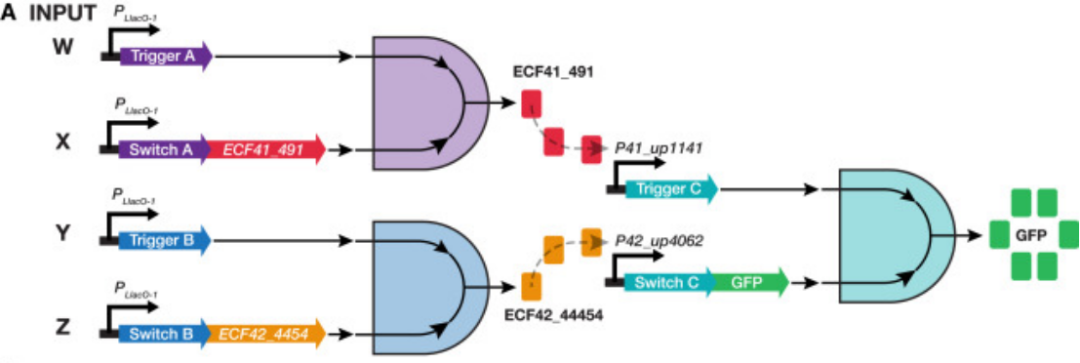
Figure 16. 邏輯回路的設計
下圖為(wei) 實驗結果,結果表明各個(ge) 輸入之間正交性良好。
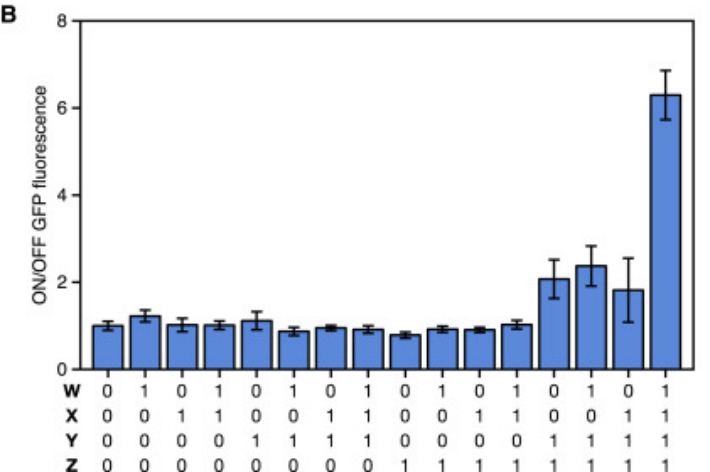
Figure 17. 4-input 與(yu) 邏輯回路實驗結果







![外交學專(zhuan) 業(ye) ]準研家長掌握5大科研提升秘籍](https://img.abigailspetspa.com/wp-content/uploads/2025/03/1743155967-10-1743155967.jpeg)






評論已經被關(guan) 閉。